ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения Димиа ®
 Торговое название
Торговое название
Димиа
Описание
Для таблеток дроспиренон + этинилэстрадиол:
белые или почти белые, круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой, диаметром около 6 мм; на одной стороне таблетки имеется гравировка "G73".
Для таблеток плацебо:
Зеленые, круглые, двояковыпуклые таблетки, покрытые пленочной оболочкой, диаметр 6 мм.
 Фармокотерапевтическая группа
Фармокотерапевтическая группа
Контрацептивное средство комбинированное (эстроген + гестаген)
Код ATX:
G03AA12
Форма выпуска, состав и упаковка
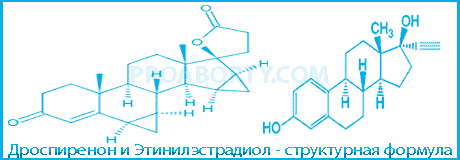
Структурная формула, брутто-формула и химическое наименование
| Действующие вещества | Брутто-формула | Химическое наименование |
| Дроспиренон | C24H30O3 | 6R,7R,8R,9S,10R,13S,14S,15S,16S,17S)-1,3',4',6,6a,7,8,9,10,11,12,13,14,15,15a,16-гексадекагидро-10,13-диметилспиро-[17H-дициклопропа-6,7:15,16]циклопента[a]фенантрен-17,2'(5H)-фуран]-3,5'(2H)-дион |
| Этинилэстрадиол | C20H24O2 | (17 альфа)-19-Норпрегна-1,3,5(10)-триен-20-ин-3,17-диол |
Фармакологические свойства
Комбинированный пероральный контрацептив (КПК), содержащий этинилэстрадиол и гестаген дроспиренон. В терапевтической дозе, дроспиренон также обладает антиандрогенным и слабым антиминералокортикоидным действием. Не обладает эстрогенной, глюкокортикоидной и антиглюкокортикоидной активностью. Таким образом, дроспиренон обладает фармакологическим профилем, близким к естественному гормону прогестерону.
В клинических исследованиях выявлено, что антиминералокортикоидные свойства препарата Димиа® приводят к слабому антиминералокортикоидному эффекту.
Обладает антиандрогенной активностью, что ведет к уменьшению образования акне и снижению продукции сальных желез, не влияет на-вызываемое этинилэстрадиолом повышение образования глобулина, связывающего половые гормоны (инактивация эндогенных андрогенов).
Индекс Перля: 0.31 (верхний 95% доверительный интервал: 0.85). Контрацептивный эффект препарата основывается на взаимодействии различных факторов, наиболее важными из которых являются торможение овуляции и изменения эндометрия.
Фармакокинетика
Дроспиренон
Всасывание
При пероральном приеме дроспиренон быстро и почти полностью абсорбируется. Максимальная концентрация дроспиренона в сыворотке, равная 37 нг/мл, достигается через 1-2 ч после однократного приема внутрь. Биодоступность колеблется от 76 до 85%. Прием пищи не влияет на биодоступность дроспиренона.
Распределение
После перорального приема уровни дроспиренона в сыворотке снижаются с конечным периодом полувыведения 31 ч. Наблюдается связь дроспиренона с сывороточным альбумином‚ но препарат не связывается с глобулином, связывающим половые гормоны (ГСПГ), или кортикостероидсвязывающим глобулином (КСГ ). Только 3-5% общих концентраций активного вещества в сыворотке представлено в виде свободного стероида. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона сывороточными белками. Средний кажущийся Vd Дроспиренона составляет 3.7±1.2 л/кг.
Во время одного цикла лечения максимальная Сss дроспиренона в сыворотке (примерно 70 нг/мл) достигается после 8 дней лечения. Сывороточные концентрации дроспиренона увеличиваются примерно на 3 порядка, вследствие соотношения конечного Т1/2 и интервала дозирования.
Метаболизм
Дроспиренон активно метаболизируется после приема внутрь. Главные метаболиты в плазме крови это кислотная форма дроспиренона, образовавшаяся при раскрытии лактонного кольца, и 4,5-дигидро-дроспиренон-3-
Выведение
Скорость метаболического клиренса дроспиренона в сыворотке составляет 1.5±0.2 мл/мин/кг. Дроспиренон экскретируется только в следовых количествах в не измененном виде. Метаболиты дроспиренона экскретируются с фекалиями и мочой в соотношении примерно 1.2:1.4. T1/2 для экскреции метаболитов с мочой и фекалиями составляет примерно 40 ч.
Этинилэстрадиол
Всасывание
Этинилэстрадиол, после перорального приема, быстро и полностью всасывается. Cmax в сыворотке крови после однократного приема 33 пг/мл достигается через 1-2 ч. После пресистемной конъюгации и пресистемного метаболизма в тонкой кишке и печени абсолютная биодоступность составляет 60%. Сопутствующий прием пищи снижает биодоступность этинилэстрадиола примерно у 25% обследованных людей, тогда как у других людей не было выявлено подобных изменений.
Распределение
Уровни этинилэстрадиола в сыворотке снижаются в две фазы, конечная фармакокинетическая фаза характеризуется Т1/2 около 24 ч. Этинилэстрадиол связывается с альбумином около 98.5% и индуцирует повышение концентрации ГСПГ И КСГ в сыворотке. Кажущийся Vd составляет приблизительно 5 л/кг.
Состояние Css достигается в течение второй половины цикла лечения, причем сывороточный уровень этинилэстрадиола увеличивается с кратностью примерно 2.0-2.3.
Метаболизм
Этинилэстрадиол подвергается пресистемному конъюгированию в слизистою тонкого кишечника и в печени. Этинилэстрадиол первично метаболизируется путем ароматического гидроксилирования, при этом образуются разнообразные гидроксилированные и метилированные метаболиты, представленные как в виде свободных метаболитов, так и в виде конъюгатов с глюкуроновой и серной кислотами. Этинилэстрадиол полностью метаболизируется. Скорость метаболического клиренса этинилэстрадиола составляет 5 мл/мин/кг.
Выведение
Этинилэстрадиол практически не экскретируется в неизмененном виде. Метаболиты этинилэстрадиола экскретируются с мочой и желчью в соотношении 4:6. Т1/2 метаболитов составляет примерно за сутки. Элиминационный Т1/2 составляет 20 ч.
Фармакокинетика у особых групп пациентов
Пациенты с нарушением функции почек. Css дроспиренона в сыворотке у женщин со слабой степенью почечной недостаточности: (КК 50-80 мл/мин) был сравним с таковым у женщин с нормальной функцией почек (КК>80 мл/мин). Уровень дроспиренона в сыворотке в среднем был на 37% выше у женщин со средней степенью почечной недостаточности (КК=30-50 мл/мин) по сравнению у женщин с нормальной функцией почек. Терапия дроспиреноном хорошо переносилась женщинами и со слабой, и со средней степенью почечной недостаточности.
Лечение дроспиреноном не оказало клинически значимого влияния на контрацепцию калия в сыворотке.
Пациенты с нарушением функции печени.
В исследовании с применением однократной дозы общий клиренс у добровольцев с умеренной печеночной недостаточностью был примерно на 50% снижен в сравнении с таковым у лиц с нормальной функцией печени.
Отмеченное снижение клиренса дроспиренона у добровольцев с умеренной печеночной недостаточностью не приводит к каким-либо значимым различиям в отношении концентрации калия в сыворотке. Даже при диабете и одновременном лечении спиронолактоном (два фактора, которые могут спровоцировать гиперкалиемию у пациента) не отмечалось увеличения концентрации калия в сыворотке выше ВГН. Можно заключить, что комбинация дроспиренон/этинилэстрадиол хорошо переносится пациентами с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью).
Этнические группы. Не выявлено клинически релевантных различий фармакокинетики дроспиренона или этинилэстрадиола у японских женщин и женщин европеоидной расы.
Показания к применению
- Пероральная контрацепция.
Препарат обладает положительным влиянием на симптомы, связанные с задержкой жидкости в организме, а также на акне и себорею, вследствие своего антиминералокортикоидному и антиандрогенного действия.
Способ применения и дозы
Таблетки необходимо принимать каждый день примерно в одно и то же время, при необходимости запивая небольшим количеством жидкости, в последовательности, указанной на упаковке. Необходимо принимать по 1 таб/сут в течение 28 дней подряд. Каждая следующая упаковка должна начинаться после приема последней таблетки из предыдущей упаковки. Кровотечение отмены обычно начинается на 23 день после приема плацебо-таблеток (последний ряд) и может не закончиться к моменту начала следующей упаковки.
Если ранее гормональные контрацептивы не использовались ( в последний месяц)
Прием препарата Димиа® начинается в первый день естественного менструального цикла женщины (т. е. в первый день менструального кровотечения).
В случае замены другого КПК, вагинального кольца или трансдермального пластыря
Для женщины предпочтительно начать прием препарата Димиа ® на следующий день после обычного безгормонального интервала в схеме предыдущего комбинированного контрацептива. При замене вагинального кольца или трансдермального пластыря прием препарата Димиа ® желательно начинать в день удаления предыдущего средства; в таких случаях прием препарата Димиа ® должен начаться не позднее дня намеченной процедуры замены.
В случае замены метода с применением только гестагенов (мини-пили, инъекционные формы, имплантаты) или внутриматочной системы ( ВМС) с высвобождением гестагенов
Женщина может перейти с мини-пили в любой день (с имплантата или ВМС в день его удаления, с инъекционной формы - со дня, когда должна была быть сделана следующая инъекция). Однако во всех этих случаях желательно использовать дополнительно барьерные контрацептивы в течение первых 7 дней приема таблеток.
После прерывания беременности в I триместре
Женщина может начать прием немедленно. При соблюдении этого условия нет необходимости в дополнительных мерах контрацепции.
После родов или прерывания беременности во II триместре
Женщине желательно начать прием препарата Димиа ® на 21-28 день после родов или прерывания беременности во II триместре. Если прием начат позднее, необходимо использовать дополнительно барьерные контрацептивы в течение первых 7 дней приема таблеток. В случае наличия полового контакта до начала приема препарата должна быть исключена беременность или необходимо дождаться первой менструации.
Прием пропущенных таблеток
Пропуск плацебо-таблетки из последнего (4-го) ряда блистера можно проигнорировать. Однако их следует выбросить во избежание непреднамеренного продления плацебо-фазы. Указания ниже относятся только к пропущенным активным таблеткам:
Если опоздание в приеме таблетки составило менее 12 ч, контрацептивная защита не снижается. Женщине необходимо принять пропущенную таблетку как можно скорее, следующие таблетки принимаются в обычное время. Если опоздание в приеме таблеток составило более 12 ч, контрацептивная защита может быть снижена. Коррекция пропущенных таблеток должна руководствоваться следующими двумя простыми правилами:
- Прием таблеток нельзя прекращать более чем на 7 дней.
- Чтобы достичь адекватного подавления гипоталамо-гипофизарно-
яичниковой системы, необходимо 7 дней непрерывного приема таблеток.
Соответственно в ежедневной практике можно давать следующие советы:
Неделя 1
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Дополнительно должен быть использован барьерный метод контрацепции в течение следующих 7 дней. Если половое сношение имело место в течение 7 дней перед пропуском таблетки, необходимо учитывать вероятность наступления беременности. Чем больше таблеток пропущено и чем ближе этот пропуск к 7-дневному перерыву в приеме препарата, тем выше риск наступления беременности.
Неделя 2
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Если женщина в течение предшествующих 7 дней принимала таблетки правильно, нет необходимости использовать дополнительные средства контрацепции. Однако, если она пропустила более чем 1 таблетку, необходимо использовать дополнительные меры предосторожности в следующие 7 дней.
Неделя 3
Вероятность снижения контрацептивного эффекта значительна из-за приближения фазы плацебо-таблеток. Однако, корректируя расписание приема таблеток, можно предотвратить снижение контрацептивной защиты. Если следовать любому из двух следующих советов, дополнительных способов контрацепции не понадобится, если в течение предшествующих 7 дней перед пропуском таблетки женщина принимала все таблетки правильно. Если это не так, она должна следовать первому из двух способов и также использовать дополнительные меры предосторожности в течение следующих 7 дней.
- Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующие таблетки принимают в обычное время до тех пор, пока активные таблетки не закончатся. 4 плацебо-таблетки из последнего ряда принимать не следует, нужно сразу начинать прием таблеток из следующей упаковки. Вероятнее всего, кровотечения "отмены" не будет до конца второй упаковки, но могут наблюдаться мажущие кровянистые выделения или прорывное маточное кровотечение в дни приема таблеток.
- Женщине можно рекомендовать прекратить прием активных таблеток из начатой упаковки. Вместо этого она должна принять плацебо-таблетки из последнего ряда в течение 4 дней, включая дни пропуска таблеток, а затем начать прием таблеток из следующей упаковки.
В случае пропуска в приеме таблеток и отсутствия кровотечения "отмены" в фазе плацебо-таблеток, необходимо исключить беременность.
Расстройства ЖКТ
В случае тяжелых реакций со стороны ЖКТ (таких как рвота или диарея), всасывание может быть неполным, и необходимо применять дополнительные меры контрацепции.
В случае рвоты в пределах 3-4 ч после приема активной таблетки, необходимо как можно скорее принять новую, заменяющую таблетку. Следующую таблетку при возможности необходимо принять в течение 12 ч после обычного времени приема. Если пропущено больше 12 ч, по возможности необходимо соблюдать правила приема препарата, указанные в разделе "Прием пропущенных таблеток". Если пациентка не хочет изменять нормальный режим приема препарата, она должна принять дополнительную таблетку (или несколько таблеток) из другой упаковки.
Как отсрочить кровотечение "отмены "
Для отсрочки дня начала менструации необходимо пропустить прием плацебо-таблеток из начатой упаковки и начать прием активных таблеток Димиа ® из новой упаковки без перерыва в приеме. Отсрочка возможна до окончания таблеток во второй упаковке.
Во время удлинения цикла могут отмечаться мажущие кровянистые выделения из влагалища или маточные прорывные кровотечения. Регулярный прием Димиа ® заканчивается после фазы плацебо.
Для переноса дня начала менструации на другой день недели обычного расписания следует укоротить предстоящую фазу плацебо-таблеток на столько дней, на сколько это необходимо. Чем короче интервал, тем выше риск того что кровотечения "отмены" не будет, а во время приема второй упаковки будут отмечаться мажущие кровянистые выделения и прорывные кровотечения (так же как в случае отсрочки начала менструации).
Побочное действие
| Часто (≥ 1/100 до 1/10) | Нечасто (≥ 1/1000 до 1/100) | Редко (≥ 1/10000 до 1/1000) |
| - головная боль, - эмоциональная лабильность; - депрессия; - тошнота; - нарушения менструального цикла (метроррагия, аменорея); - межменструальные кровотечения; - боль в груди. |
- головокружение; - мигрень; - нервозность; - сонливость; - снижение настроения; - парестезия; - гипертония; - варикозное расширение вен; - болезненность и напряженность молочных желез; - фиброкистозные изменения молочной железы; - тошнота; - рвота; - гастрит; - боль в животе; - диспепсия; - метеоризм; - диарея; - акне; - кожный зуд; - сухость кожи; - боли в спине; - боли в конечностях; - мышечные судороги; - снижение либидо; - вагинальные выделения; - канлидоз влагалища; - сухость во влагалище; - вагинит; - нарушения менструального цикла (дисменорея‚ гипоменорея, меноррагия); - астения; - усиленное потоотделение; - задержка жидкости в организме; - повышение массы тела. |
- снижение массы тела, - повышение аппетита, - анорексия, - крапивница, - анемия, - тромбоцитопения, - гиперкалиемия, - гипонатриемия, - аноргазмия, - бессонница, - вертиго, - тремор, - носовое кровотечение, - обморок, - тромбоэмболия, - венозные тромбозы/тромбоэмболии, - артериальные тромбозы/тромбоэмболии, - конъюнктивит, - сухость в глазах, - плохая переносимость контактных линз, - тахикардия, - артериальная гипертензия, - опухоли печени, - болезнь Крона, - неспецифический язвенный колит, - эпилепсия, - эндометриоз, - миома матки, - порфирия, - системная красная волчанка, - герпес беременных, - хорея Сиденхема, - гемолитический уремический синдром, - холестатическая желтуха, - хлоазма, - сухость кожи, - угревой или контактный дерматит, - ангионевротический отек, - экзема, - гипертрихоз, - фотодерматит, - узловатая эритема, - многоформная эритема, - киста молочной железы, - гиперплазия молочной железы, - болезненный половой акт, - посткоитальное кровотечение, - кровотечение отмены, - полипы шейки матки, - атрофия эндометрия, - киста яичника, - увеличение матки, - повышение либидо. |
Противопоказания
- беременность;
- период грудного вскармливания;
- наличие тромбозов вен в настоящее время или в анамнезе (например, тромбоз глубоких вен, тромбоэмболия легочной артерии);
- наличие тромбозов артерий в настоящее время или в анамнезе (например, инфаркт миокарда) или предшествующих состояний (например, стенокардия и транзиторная ишемическая атака);
- цереброваскулярные заболевания в настоящее время или в анамнезе; наличие тяжелых или
- множественных факторов риска артериального тромбоза;
- сахарный диабет с сосудистыми осложнениями;
- выраженная артериальная гипертензия;
- выраженная дислипопротеинемия;
- наследственная или приобретенная предрасположенность к венозным или артериальным тромбозам, такая как резистентность к АРС (активированному протеину С), недостаточность антитромбина 3, недостаточность протеина С, недостаточность протеина S, гипергомоцистеинемия и антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт);
- панкреатит с выраженной гипертриглицеридемией, в т.ч. в анамнезе;
- тяжелые заболевания печени (до нормализации печеночных проб) в настоящее время или в анамнезе; выраженная хроническая почечная недостаточность или острая почечная недостаточность;
- опухоли печени (доброкачественные или злокачественные), в настоящее время или в анамнезе;
- гормонозависимые злокачественные заболевания половой системы (половых органов, молочных желез) или подозрение на них;
- вагинальное кровотечение неясного генеза;
- мигрень с местной неврологической симптоматикой в анамнезе;
- непереносимость галактозы, лактазная недостаточность или синдром мальабсорбции глюкозы и галактозы;
- повышенная чувствительность к активному веществу или любому из вспомогательных веществ.
Беременность и лактация
Если беременность наступила на фоне приема Димиа ®‚ препарат необходимо немедленно отменить. Проведенные эпидемиологические исследования не выявили ни увеличения риска при родах для детей у женщин, принимавших КПК до беременности, ни тератогенного эффекта, когда КПК непреднамеренно принимались во время беременности. Таких исследований с препаратом не проводилось.
КПК могут влиять на лактацию, поскольку они могут уменьшать количество и изменять состав грудного молока. Таким образом, использование КПК нельзя рекомендовать, пока кормящая женщина полностью не прекратит грудное вскармливание. Небольшие количества контрацептивных гормонов или их метаболитов могут выделяться с молоком во время применения КПК. Эти количества могут оказывать влияние на ребенка.
Особые указания
Если какие-либо из состояний/факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения КПК в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае ухудшения, усиления или первого проявления любого из этих состояний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены КПК.
Нарушения системы кровообращения
Эпидемиологические исследования показали, что частота ВТЭ (венозная тромбоэмболия) у женщин без факторов риска ВТЭ, принимающих КПК с низкой дозой эстрогенов (< 50 мкг этинилэстрадиола) составляет примерно от 20 случаев на 100 000 женщин в год (для левоноргестрел-содержащих КПК второго поколения) или до 40 случаев на 100 000 женщин в год (для дезогестрел/гестоден-
Применение любых комбинированных оральных контрацептивов связано с увеличенным риском тромбоэмболии вен, сравнимым с таковым без использования. Дополнительный риск максимален в течение первого года использования комбинированного орального контрацептива. Тромбоэмболия вен приводит к летальному исходу в 1-2% случаев.
Эпидемиологические исследования также связывают прием КПК с повышенным риском артериальной тромбоэмболии (инфаркт миокарда, транзиторные ишемические атаки).
У женщин, принимающих комбинированные пероральные контрацептивы, описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных артерий и вен, центральной вены сетчатки и ее ветвей.
Симптомы венозного или артериального тромбоза тромбоэмболии или цереброваскулярного заболевания могут включать:
- необычную одностороннюю боль и/или отек конечности;
- внезапную сильную боль в груди, с или без иррадиации в левую руку; внезапную одышку;
- внезапный приступ кашля;
- любую необычную, сильную, длительную головную боль;
- внезапную частичную или полную потерю зрения;
- диплопию;
- нечленораздельную речь или афазию;
- головокружение;
- потерю сознания с или без судорожного припадка;
- слабость или крайне выраженную потерю чувствительности, внезапно появившуюся с одной стороны или в одной части тела;
- двигательные нарушения;
- симптом "острого живота".
Риск осложнений, связанных с тромбоэмболией вен при приеме КПК, увеличивается:
- с возрастом;
- при наличии семейного анамнеза (венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в относительно молодом возрасте); если предполагается наследственная предрасположенность, женщине необходима консультация специалиста перед назначением КПК;
- после длительной иммобилизации, серьезного хирургического вмешательства, любой операции на ногах или обширной травмы. В этих ситуациях рекомендуется прекратить прием препарата (в случае плановой операции, по крайней мере, за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Дополнительно возможно назначение антитромботической терапии, если прием таблеток не был прекращен в рекомендуемые сроки;
- ожирение (индекс массы тела более 30 мг/м2);
- нет единого мнения о возможной роли варикозного расширения вен и тромбофлебит поверхностных вен в начале или прогрессировании венозного тромбоза.
Риск артериальных тромбозмболических осложнений тромбоза цереброваскулярного нарушения у женщин, принимающих КПК, повышается:
- с возрастом;
- у курящих (женщинам старше 35 лет строго не рекомендуется курить, если они хотят применять КПК);
- при дислипопротеинемии;
- при гипертензии;
- при мигрени;
- при заболеваниях клапанов сердца;
- при фибрилляции предсердий.
Наличие одною из серьезных факторов риска или множественных факторов риска заболевания артерий или вен, соответственно, может быть противопоказанием. Женщины, применяющие КПК, должны немедленно обращаться к врачу при возникновении симптомов возможного тромбоза. В случаях подозрения на тромбоз или подтвержденного тромбоза прием КПК необходимо прекратить. Необходимо подобрать адекватный метод контрацепции вследствие тератогенности антикоагулянтной терапии (кумарины).
Следует учитывать повышенный риск тромбоэмболии в послеродовом периоде.
Другие заболевания
Другие заболевания, которые связаны с тяжелой сосудистой патологией, включают сахарный диабет, системную красную волчанку, гемолитический уремический синдром, хронические воспалительные заболевания кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточную анемию.
Увеличение частоты и тяжести мигрени во время использования КПК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов.
О повышенном риске развития рака шейки матки при длительном применении комбинированных пероральных контрацептивов сообщалось в некоторых эпидемиологических исследованиях. Его связь с приемом КПК не доказана. Сохраняются противоречия относительно того, в какой степени эти результаты относятся к особенностям полового поведения и другим факторам, типа вируса папилломы человека (HPV).
Рак молочной железы
Мета-анализ 54 эпидемиологических исследований продемонстрировал, что присутствует несколько повышенный относительный рис (RR=1.24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования использовали комбинированные пероральные контрацептивы. Его связь с приемом КПК не доказана. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих комбинированные пероральные контрацептивы. Раковые опухоли молочных желез у женщин, когда-либо употреблявших комбинированные пероральные контрацептивы, были клинически менее выражены, чем у женщин, никогда не употреблявших подобные препараты. В редких случаях на фоне применения КПК наблюдалось развитие доброкачественных опухолей печени, а в крайне редких случаях - развитие злокачественных опухолей печени. В отдельных случаях эти опухоли приводят к жизнеугрожаюшему внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения при проведении дифференциального диагноза у женщины принимающей КПК, следует учитывать вероятность развития опухоли печени.
Другие состояния
Прогестиновый компонент в препарате Димиа ® является антагонистом альдостерона с калийсберегаюшими свойствами. В большинстве случаев не предполагается повышения уровня калия. Но в клиническом исследовании у некоторых пациенток с легкой или умеренной степенью нарушения функции почек сопутствующий прием калийоберегающих препаратов незначительно повышал сывороточные уровни калия при приеме дроспиренона. Поэтому рекомендуется проверять уровень сывороточного калия в ходе первого цикла лечения у пациентов с почечной недостаточностью, у которых сывороточный уровень калия до лечения был на верхней границе нормы, и которые дополнительно используют калийсберегающие препараты.
У женщин с гипертриглицеридемией‚ или семейным анамнезом этого заболевания нельзя исключить повышение риска развития панкреатита во время приема КПК. Хотя небольшое повышение АД сообщаюсь у многих женщин, принимающих комбинированные пероральные контрацептивы, клинически значимые повышения отмечались редко. Только в редких случаях оправдана незамедлительная отмена КПК. Если во время приема КПК при существующей артериальной гипертензии постоянно или значимо повышенное АД адекватно не отвечает на гипотензивное лечение, стоит прекратить прием КПК.
Следующие состояния, как было сообщено, развиваются или ухудшаются как во время беременности, так и при приеме КПК, но их связь с приемом КПК не доказана: желтуха и/или зуд, связанный с холестазом, формирование камней в желчном пузыре, порфирия, системная красная волчанка, гемолитический уремический синдром, хорея Сиденхема, герпес беременных, потеря слуха, связанная с отосклерозом. У женщин со склонностью к отеку Квинке экзогенные эстрогены могут индуцировать или усилить симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать отмены КПК до тех пор, пока показатели функции печени не вернутся в норму. Рецидивирующая холестатическая желтуха и/или зуд, связанный с холестазом, которые развились впервые во время беременности или предыдущего приема половых гормонов, требуют прекращения приема КПК. Хотя КПК могуг оказывать влияние на резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у больных сахарным диабетом, использующих комбинированные оральные контрацептивы (содержащие < 0.05 мг этинилэстрадиола). Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться, особенно на ранней стадии приема КПК.
Также описаны случаи болезни Крона и неспецифического язвенного колита на фоне применения КПК, однако, связь с приемом препаратов не доказана.
При приеме КПК сообщалось об ухудшении эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита.
В редких случаях может развиваться хлоазма, особенно у женщин с пигментацией кожи во время беременности. Женщины со склонностью к хлоазме во время приема КПК должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения. Препарат содержит 48.53 мг лактозы в одной таблетке и 37.26 мг безводной лактозы в одной неактивной таблетке. Пациенты с редко встречающейся наследственной непереносимостью галактозы, лактазной недостаточностью или нарушениями всасывания глюкозы-галактозы, находящиеся на безлактозной диете, должны иметь это в виду.
У женщин с аллергией на соевый лецитин могут возникнуть легкие аллергические реакции.
Медицинские осмотры/консультации
Перед началом применения или возобновлением приема препарата Димиа женщине рекомендуется пройти тщательное общемедицинское обследование (включая анамнез), исключить беременность. Должно быть измерено АД и проведен физикальный осмотр. Врач должен руководствоваться противопоказаниями к приему КПК и предупреждениями. Женщину следует проинструктировать, чтобы она тщательно прочла аннотацию и следовала полученной консультации. Частота и суть обследований должна основываться на определенных практических руководствах и адаптироваться под особенности каждой женщины.
КПК не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Сниженная эффективность
Эффективность КПК может снижаться при пропуске приема таблеток, при желудочно-кишечных расстройствах или сопутствующем приеме препаратов.
Сниженный контроль цикла
На фоне приема всех КПК могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или кровотечение "отмены"), особенно в течение первых месяцев использования. Поэтому оценка любых нерегулярных кровотечений является значимой только после периода адаптации, составляющего приблизительно три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, то должны быть рассмотрены негормональные причины и проведены адекватные диагностические мероприятия для исключения злокачественных новообразований или беременности. Они могут включать выскабливание.
У некоторых женщин кровотечение отмены может не развиваться во время перерыва в приеме таблеток. Если КПК принимались согласно указаниям, маловероятно, что женщина беременна. Тем не менее, если до этого КПК принимались нерегулярно или, если отсутствуют подряд два кровотечения "отмены", до продолжения приема КПК должна быть исключена беременность.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований, изучающих влияние препарата на способность вождения автомобиля и на работу с механизмами с повышенным риском травматизма, не проводилось.
Передозировка
Симптомы: тошнота, рвота, небольшое влагалищное кровотечение у молодых девушек.
Лечение: симптоматическое.
Взаимодействие с другими лекарственными средствами
Некоторые препараты вследствие индукции микросомальных ферментов способны увеличивать клиренс половых гормонов (гидантоин, фенитоин, барбитураты, примидон, карбамазепин и рифампицин; также возможно такое же влияние оксикарбазепина, топирамата, фелбамата, ритонавира, гризеофульвина и растительного средства на основе зверобоя (Hypericum perforatum)). Максимальная индукция микросомальных ферментов печени обычно не проявляется в течение 2-3 недель, но может затем сохраняться, по крайней мере, в течение 4 недель после прекращения лекарственной терапии. Сообщалось о возможном действии ингибиторов ВИЧ-протеаз (например, ритонавира) и ненуклеозидных ингибиторов обратной транскриптазы (например, невирапина) и их сочетаний на метаболизм в печени.
Одновременное назначение с некоторыми антибиотиками, такими как пенициллины и тетрациклины, снижает кишечно-печеночную рециркуляцию эстрогенов, что может приводить к снижению концентрации этинилэстрадиола.
Женщины, получающие любые из вышеупомянутых классов лекарственных препаратов или отдельные активные вещества, должны использовать барьерный метод контрацепции в дополнение к препарату Димиа ® или перейти на любой другой метод контрацепции. Женщины, получающие постоянное лечение препаратами, содержащими активные вещества, влияющие на печеночные ферменты, в течение 28 дней после их отмены дополнительно должны использовать негормональный метод контрацепции.
Женщины, получающие терапию рифампицином, кроме приема КПК должны использовать барьерный метод контрацепции и продолжать его использование в течение 28 дней после прекращения лечения рифампицином. Если прием сопутствующих препаратов длится дольше срока окончания активных таблеток в упаковке, плацебо таблетки следует выбросить и сразу начать прием активных таблеток из следующей упаковки.
Основной метаболизм дроспиренона в плазме человека генерируется без вовлечения системы CYP. Ингибиторы этой ферментной системы, таким образом, не влияют на метаболизм дроспиренона.
Пероральные контрацептивы могут влиять на метаболизм отдельных других активных соединений. Кроме того, могут изменяться их концентрации в плазме и тканях как повышаться (например, циклоспорин), так и снижаться (например, ламотриджин).
У женщин-добровольцев, принимающих омепразол, симвастатин и мидазолам в качестве индикаторов-субстратов, влияние дроспиренона в дозе 3 мг на метаболизм других активных веществ маловероятно.
У пациентов с почечной недостаточностью, одновременное назначение дроспиренона и ингибиторов АПФ или НПВП не оказывает существенного влияния на уровень калия в сыворотке крови. Однако одновременное применение препарата Димиа ® и антагонистов альдостерона или калийсберегаюших диуретиков не изучалось. В этом случае необходимо исследование уровня калия в сыворотке в течение первого цикла приема препарата.
Необходимо обсуждать одновременное назначение препаратов, чтобы выявить возможное лекарственное взаимодействия.
Прием гормонов для контрацепции может влиять на результаты отдельных лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, а также уровни транспортных белков плазмы, таких как кортикостероидсвязываюший глобулин и липидно/липопротеиновые фракции, показатели углеводного обмена, коагуляции и фибринолиза. Изменения обычно происходят в пределах лабораторных норм.
Вследствие своей небольшой антиминералокортикоидной активности дроспиренон повышает активность ренина и альдостерона плазмы крови.
Условия хранения и сроки годности
Препарат следует хранить в оригинальной упаковке, в недоступном для детей, защищенном от света месте при температуре от 15° до 25°С. Срок годности - 2 года.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Аналоги
Решение о замене препарата принимает лечащий врач, не принимайте его самостоятельно.
Производитель
ОАО «Гедеон Рихтер». 1103, Будапешт, ул. Демреи, 19-21, Венгрия.
| Описание, размещенное на этой странице, является сокращенным и дополненным вариантом официальной версии аннотации к препарату. Информация представлена исключительно в ознакомительных целях и не должна служить основанием для принятия самостоятельного решения о применении конкретного лекарственного препарата. Необходимо проконсультироваться со специалистом и воспользоваться инструкцией утвержденной производителем. |